液体的沸点和大气压有什么关系
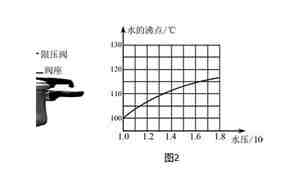
液体的沸点是指液体在标准大气压下变为气态的温度。当大气压强发生变化时,液体的沸点也会相应地发生调整。沸点与大气压的关系遵循著名的"盖-吕萨克定律"和"查理定律",在理想气体模型中,它表述为:
1. 盖-吕萨克定律:对于一定量的气体,如果温度保持不变,那么气体的体积与压力成反比。当大气压降低时,液体上方的气体压力减小,液面上的蒸汽压也会降低,使得液体需要更高的温度才能沸腾,即沸点上升。
2. 查理定律:对于理想气体,无论体积如何,其压强与绝对温度成正比。同样,如果降低大气压,液体的沸点会随着气压的减小而降低,因为沸点是液体分子克服表面张力转变为气态的临界点,气压减小意味着分子克服阻力的阈值更低。
总结来说,液体的沸点与大气压直接相关:在标准大气压下,沸点是固定的;若气压降低,沸点会上升;若气压升高,沸点则会降低。这是因为在较低的气压下,液体分子需要更多的能量才能达到沸点,反之亦然。
液体沸点与大气压的关系公式
液体的沸点确实与大气压有关,这是由于沸点反映了液体分子从液态变为气态的临界能量。其关系可以通过克劳修斯-克拉珀龙方程来表示,这是一个理想气体状态方程的推广形式,适用于液体的蒸气压和沸点:
\[ P = \frac{RT}{v_m - b} \]
在这个公式中:
\( P \) 是气压(包括液体上方的蒸气压),
\( R \) 是气体常数,
\( T \) 是绝对温度(以开尔文为单位),
\( v_m \) 是液体的摩尔体积(在沸点时液体和蒸汽的平均体积),
\( b \) 是液体的饱和蒸气压项(也称为范德华常数,反映了分子间相互作用的影响)。
对于纯液体,当\( T \)等于沸点时,\( v_m \)会显著变大,因为液态转变为气态,而\( b \)是一个固定值。所以,沸点\( T_b \)可以表达为:
\[ P_b = \frac{R T_b}{v_m(T_b) - b} \]
这里,\( P_b \) 是沸点时的气压。通过解这个方程,我们可以估算不同大气压下液体的沸点。实际应用中,大气压的标准值(1大气压,即101,325帕斯卡)通常用来计算沸点,除非特别指定其他气压条件。